Virus de l’immunodéficience humaine VIH
Les virus de l’immunodéficience humaine (HIV) appartiennent à la famille des Rétrovirus.
Ces derniers sont caractérisés par leur matériel génétique qui est constitué de deux molécules d’acide ribonucléique (ARN) associées à deux molécules d’une enzyme: la réverse transcriptase (RT) ou transcriptase inverse, qui est une ADN polymérase ARN dépendante, permettant de synthétiser un acide désoxyribonucléique (ADN), double brin, complémentaire de l’ARN viral, dans la cellule infectée par le rétrovirus.
Cet ADN néoformé possède à chaque extrémité une même séquence répétitive de taille variable dite LTR (Long Terminal Repeat), il peut alors s’intégrer de manière stable dans l’ADN chromosomique de la cellule devenant un provirus.
Ce provirus se comporte comme un gène de la cellule et peut soit, rester silencieux en se contentant d’être transmis aux cellules filles à chaque mitose, soit s’exprimer et être transcrit en ARN messager (ARNm), traduit ensuite en protéines virales, pour donner naissance à des particules virales identiques au virus infectieux de départ.
Classification
Les rétrovirus constituent une grande famille de virus pouvant infecter pratiquement toutes les espèces animales.
Il existe trois sous familles ou catégories de rétrovirus classés selon des critères de pathogénie et de divergences génétiques : les Oncovirus, les lentivirus, et les Spumavirus (tableau n°1)
Les virus VIH appartiennent à la catégorie des Lentivirus.
Ces derniers n’ont pas de pouvoir transformant, sont lytiques, sont responsables de la destruction cellulaire et de la mort de la cellule infectée (effet cytopathogène) et sont responsables d’infection à évolution lente.
Tableau n° 1 : Classification des rétrovirus
Sous-famille |
Groupe | Exemple | Commentaire |
| Oncovirinae | Aviaires sarcome, leucémie | Rous Sarcoma Virus (RSV) | Sarcome du poulet oncogène src |
| Avian myeloblastosis virus (AMV) | Oncogène myc | ||
| Mammifères (type C) | Molonley murine
Leukemia virus (Mo-MLV) |
Lymphome à cellules T de la souris | |
| Feline Leukemia
Virus (FeLV) |
Lymphome à cellules T du chat et immunodéficience | ||
| Virus de type B | Mouse Mammary
Tumor virus (MMTV) |
Carcinome mammaire de la souris | |
| Virus de type D | Mason-Pfizer
Monkey virus (MPMV) |
Syndrome d’immunodéficience du singe | |
| HTLV-BLV | Human T-cell Leukemia
Virus (HTLV) |
Leucémies et lymphomes à cellules T-Syndromes neurologiques | |
| Bovine Leukemia virus (BLV) | Lymphomes à cellules B du bœuf | ||
| Lentivirinae | Lentivirus | Visna/Maedi | Pneumopathie interstitielle et syndrome neurologique du mouton |
| Equine Infectious Anemia virus (EIAV) | Anémie du cheval | ||
| Caprine Arthritis
Encephalitis Virus (CEAV) |
Arthrite et encéphalite de la chèvre | ||
| Feline Immunodeficiency
Virus (FIV) Bovine Immunodeficiency Virus (BIV) Simian Immunodeficiency Virus (HIV1-HIV2) |
Syndrome d’immunodéficience du :
· chat · bœuf · singe |
||
| Human Immunodeficiency
Virus (HIV1-HIV2) |
SIDA | ||
| Spumavirinae | « Foamy » virus | Plusieurs Isolats chez le singe et l’homme | Pathogénicité inconnue |
STRUCTURE ET ORGANISATION GÉNOMIQUE
- Structure :
Les VIH appairassent en microscopie électronique dans leur forme type comme ayant une forme sphérique d’un diamètre d’environ 90 à 120nm (un nanomètre= un milliardième de mètre), sortant de la cellule par bourgeonnement à travers la membrane cytoplasmique.
Ils sont entourés par une enveloppe d’origine cellulaire dans laquelle sont ancrées les molécules de glycoprotéine d’enveloppe externe (gp120 pour le VIH1 et gp 125 pour le VIH2) et de glycoprotéine transmembranaire (gp 41 pour le VIH1 et gp 136 pour le VIH2 ).
L’enveloppe virale est tapissée intérieurement par des molécules protéiques qui jouent le rôle de facteur stabilisant de la particule virale mature et qui servirait d’échafaudage supportant les projections de surface, voir de « pont » entre nucléocapside et glycoprotéine de l’enveloppe. Il s’agit des protéines de la matrice et de la protéase virale.
La capside virale apparaît électron- dense et de forme allongée, sous une forme de trapèze au centre de la particule virale. Elle est constituée par une protéine interne majeure (car la plus abondante), la p24 dont le poids moléculaire et de 24.000 pour le VIH1 et la p26 dont le poids moléculaire et de 26.000 pour le VIH2.
C’est à l’intérieur de la capside que sont présentes les protéines de la nucléocapside, les enzymes (reverse transcriptase et intégrase) et les deux molécules d’ARN (Fig1).
- Organisation génomique :
Le génome du VIH1 comporte plus de 9200 nucléotides et une longueur de 9,6 kilobases.
Il est flanqué de chaque extrémité par des régions répétitives appelées LTR ou « Long Terminal Repeat »,la majeure partie du génome correspond aux trois gènes caractéristiques des rétrovirus appelés gag, pol et env.
C’est à partir de ces trois gènes que sont synthétisés respectivement les protéines internes (p17, p24, p7), les enzymes virales (protéases, reverse transcriptase, integrase) et les glycoprotéines d’enveloppe (gp120, gp41).
Seulement l’organisation génomique des VIH est extrêmement complexe. Outres ces trois gènes, communs à tous les rétrovirus, elle comprend sept autres gènes qui ont notamment des fonctions de régulation (Vif, vpr, tat, rev, vpu, nef et vpx).
L’expression différentielle de tous ces gènes constitue l’une des clés de la régulation du cycle viral et de la pathogenèse du VIH (Fig. 2).

Fig. 1 : Structure des virus VIH 1 et VIH 2

Fig. 2 : Organisation génomique des VIH 1 et VIH 2
Cycle réplicatif
Le cycle de réplication des virus VIH comprend différentes étapes :
- Fixation- présentation :
Cette étape est basée sur l’interaction du virus avec son récepteur cellulaire. Les structures de surface des VIH jouent un rôle primordial dans cette première étape.
Les deux glycoprotéines de l’enveloppe sont directement impliquées dans le mécanisme de fixation et de fusion.
L’entrée du virus à l’intérieur de la cellule est basée sur la reconnaissance entre la molécule CD4 (lymphocyte CD4) et la glycoprotéine externe gp120. Cette interaction aboutit à un changement conformationnel de la gp120 qui permet la reconnaissance d’autres domaines de cette même protéine par des protéines de surface appelées co-récepteurs. Il s’agit des molécules CCR5 au niveau des macrophages et des molécules CX CR4 au niveau des lymphocytes. La fusion de l’enveloppe virale et de la membrane cytoplasmique des cellules cibles se fait grâce à la glycoprotéine trans-membranaire gp41.
- Intégration génomique :
Cette étape s’effectue uniquement par les enzymes virales, sans expression des gènes viraux ni intervention de mécanisme cellulaire. A partir de l’ARN viral simple brin, la transcriptase inverse va synthétiser un ADN double brin adapté à l’intégration dans l’ADN cellulaire. Cette intégration à lieu grâce à une enzyme, l’intégrase. L’ADN viral intégré est appelé provirus.
Le provirus peut rester latent sans donner des signes de sa présence pendant des mois voire des années.
- Cycle productif :
L’infection virale latente persiste tant que la cellule infectée n’est pas soumise à une activation par des produits des gènes cellulaires exprimés dans les cellules activées.
L’expression virale se déroule suite à l’intervention de protéines régulatrices virales ou cellulaires, la transcription de l’ADN proviral est activée dans la cellule hôte. Grâce à l’action des enzymes cellulaires de type II, l’ADN proviral est transcrit en ARN génomique et en ARN messager. L’intensité de cette transcription est contrôlée en partie par les protéines virales régulatrices.
Cette étape aboutit à la synthèse d’ARN qui serviront de génomes pour les nouvelles particules virales, des protéines de structure et des protéines enzymatiques qui serviront à former les nouvelles particules virales.
Les protéines sont synthétisées sous forme de protéines de fusion (polyprotéines) inactives qui sont ensuite clivées par des protéases d’origine virale pour la polyprotéine gag-pol et par des protéases d’origine cellulaire pour la polyprotéine env.
Cette dernière subit des phénomènes de glycosylation par des enzymes de la cellule infectée. L’assemblage s’effectue à proximité de la membrane cellulaire.
Les particules virales complètes sont libérées par bourgeonnement et vont alors à leur tour infecter d’autres cellules cibles accélérant ainsi la dissémination (Fig. 3).
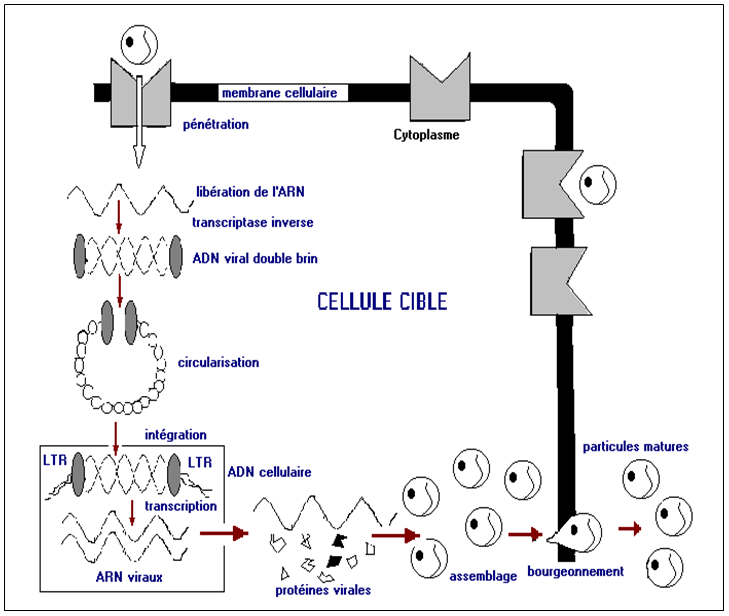
Fig. 3 : Cycle de réplication du VIH dans un lymphocyte CD4
Protéines et fonctions des gènes de structure et les gènes régulateurs (BARRE –SINOUSSI,1993)
| GENES VIRAUX | PROTEINES | FONCTIONS | |
| LES GENES CLASSIQUES DES
RETROVIRUS |
GAG | P18
P25 P13 |
Protéine de la capside
Protéine de nucléocapside Rôle dans l’encapsidation |
| POL | P18
P68-P51 P34 |
Protéase virale
Transcriptase inverse Endonuclease (intégrase) |
|
| ENV | GP 120
GP 41 |
Tropisme cellulaire Fixation au récepteur CD4.
Effet cytopathogène Fusion membranaire |
|
| GENES DE REGULATION DES HIV | Tat | P41 | Régulation: positive |
| Rev | P19 | Régulation : positive (protéine gag ,pol ,env)
Régulation: négative (protéines de régulation) |
|
| Nef | P24 | Régulation :négative
(latence) |
|
| Vpr | P15 | Vitesse de réplication | |
| Vif | P23 | Activation du pouvoir
infectieux |
|
| Vpu (HIV 1) | P16 | ? | |
| Vpx (HIV 2) | P16 | ? | |
- Effet Cytopathogène :
La réplication d’une particule virale dans un lymphocyte CD 4 aboutit habituellement soit à la mort de cette cellule soit à un effet Cytopathogène. Ce dernier est caractérisé par l’apparition de cyncytia consécutifs à la fusion de cellules en agrégats avec de multiples noyaux et un ballonnement de la membrane cellulaire (cellules multinuclées).
- Cellules cibles :
Les cellules cibles du VIH sont caractérisées par la présence, à leur surface, du récepteur CD4, sur lequel viendra se fixer le virus.
Les cellules cibles sont de deux types :
– Les lymphocytes CD 4 du sang périphérique
les virus sont généralement hautement réplicatifs dans les lymphocytes CD4 activés et induisent un effet cytopathogène. Ces cellules possèdent le co-récepteur CXCR4.
– Les cellules présentatrices d’Antigènes.
- Cellules de la lignée monocytaire :
- Monocytes (sang circulant)
- Macrophages tissulaires
- Cellules microgliales du cerveau.
- Cellules dendritiques :
- Cellules folliculaires dendritiques (ganglions)
- Cellules de langherans (peau et muqueuse)
Ces cellules possèdent le co-récepteur CCR5.
- Variabilité génétique:
Les rétrovirus, comme tous les virus à ARN, sont connus pour leur très grande variabilité génétique. Ce phénomène est attribué au fait que le génome est répliqué en l’absence d’enzymes de correction, lesquelles garantissent la fidélité de réplication des génomes à ADN.
Les ARN polymérase virales, ainsi que la RT sont des enzymes peu fidèles qui ne comportent pas de système de réparation en cas d’incorporation erronée d’un nucléotide.
La variabilité génétique des VIH est extrême et deux souches ne sont jamais semblables. Chez un même individu le virus est présent sous forme de « micro variants » ou « quasi-espèce », génétiquement reliés les uns aux autres mais différents.
Cette variabilité génétique a été remarquée dès la découverte des VIH.
En effet au niveau génomique, l’homologie entre les séquences nucléotidiques du VIH 1 et du VIH 2 est de moins de 50% (40% – 42%). La partie génomique la plus conservée est celle qui comporte les gènes gag et pol. Le niveau de divergence est élevé entre le VIH 1 et le VIH 2 notamment au niveau des antigènes de l’enveloppe. Chaque type de virus est lui-même représenté par des virus génétiquement éloignés.
Actuellement le virus VIH1 est subdivisé en trois groupes de virus : Les VIH 1 du groupe M (Majoritaire), les VIH 1 du groupe O (« Outlier ») et les VIH 1 du groupe N (Non M Non O ou new).
VIH1 du groupe M : Les virus de ce groupe sont les plus répandus dans le monde. A l’intérieur de ce groupe on a identifié 9 sous types (A ,B, C D,F, G, H, J et K) variant de 20% à 30% de l’un à l’autre, ainsi que 43 formes recombinantes (CRF : circulating recombinant form) à ce jour.ces formes recombinantes résultent d’échange de matériel génétique entre différents sous types.
Le sous type B est retrouvé en Europe, en Amérique du nord et en Australie, les sous types non B (A-C, D… etc.) sont retrouvés en Afrique et en Asie. Tous les sous types sont présents en Afrique centrale.
Le sous type B représente 56 % des souches en Algérie particulièrement au nord du pays.les sous types non B sont localisés essentiellement au sud. Plusieurs CRF ont été également retrouvés.
-VIH1 du groupe O (Outlier) : Ce groupe rassemble actuellement de nombreux isolats originaires du Cameroun et du Gabon. Ces sous types sont plus rares.
Le VIH1 du groupe O est résistant aux inhibiteurs non nucléosidiques de la transcriptase inverse (INNTR).
VIH1 du groupe N (non-M, non-O) : Les isolats sont originaires du Cameroun. Ils sont Hautement divergents et sont proche de la souche SIV CPZ (Simian Immunodeficiency Virus du chimpanzé).
VIH1 du groupe P (putative) :isolé en 2009 chez une patiente originaire du Cameroun
La variabilité des VIH a de nombreuses conséquences dont, la difficulté de développer un vaccin préventif et la sélection de mutants résistants aux antirétroviraux.
Variabilité génétique du VIH2 :
Le type VIH2 est essentiellement restreint à l’Afrique de l’ouest, il est moins prévalent que le VIH1.
Le VIH2 comprend 8 sous-types, les sous-types A et B seuls ayant une importance épidémiologique. il n’existe pas de différences clinique ni immunologique entre les patients infectés par le VIH2 de sous-type A ou de sous-type B.
Les VIH2 sont phylogénétiquement liés aux SIV infectant les singes mangabé de l’Afrique de l’ouest.
- Modes de transmission:
Les modes de transmission de l’infection VIH sont connus.
Il s’agit de la transmission sexuelle, la transmission sanguine et la transmission de la mère à l’enfant.
- Transmission sexuelle :
Les virus VIH sont présents dans les sécrétions vaginales et le sperme. Ils sont transmis lors de rapports homosexuels ou hétérosexuels. Ce mode de transmission est le plus répandu actuellement.
En effet, le risque de transmission dépend du type de relation sexuelle et aussi de la quantité du virus présent dans le sperme ou dans les sécrétions vaginales. Les autres maladies sexuellement transmissibles augmentent le risque de contamination par le VIH (Syphilis, herpes virus…)
- Transmission sanguine :
La transmission des virus VIH par le sang est effectuée lors d’une :
- Transfusion de sang ou de dérivés sanguins,
- Exposition percutanée à du sang infecté (personnel soignant) ,
- Utilisation de drogues par voie intraveineuse (toxicomanes).
La transmission par transfusion de sang ou de dérivés sanguins est devenue presque nulle dans les pays industrialisés suite au dépistage systématique lors des dons de sang, et aux améliorations techniques liées au dépistage.
- Transmission mère- enfant :
La transmission du virus VIH de la mère à l’enfant a lieu surtout pendant l’accouchement. Elle peut également survenir en fin de grossesse et lors de l’allaitement
L’utilisation des anti-retroviraux pendant la grossesse a permis la réduction du risque de transmission mère- enfant.
- Evolution des marqueurs virologiques
Une bonne connaissance de la cinétique des anticorps, de l’antigène P24 et de l’ARN plasmatique est indispensable à l’interprétation des tests VIH.
Le virus est détectable sous sa forme d’ARN dés le 10-12éme jour (8à17 jours) et sous sa forme de P24 dés le 12-14éme jour après le contage.
Les Ac spécifiques apparaissent dans les 3 à 9 semaines qui suivent l’entrée du virus dans l’organisme humain (moyenne de 4 à 6 semaines).
Cette cinétique peut varier en fonction de chaque patient et aussi de la souche infectant.

Diagnostic virologique
Le diagnostic virologique de l’infection VIH est avant tout un diagnostic sérologique (chez l’enfant de plus de 18 mois et chez l’adulte) basé sur la recherche d’anticorps(Ac) sériques spécifiques.
Ces anticorps peuvent être recherchés dans le cadre d’un dépistage de routine ou d’une confirmation du diagnostic. Le dépistage est volontaire, mais largement proposé et toujours prescrit par un médecin avec le consentement du patient. Il est obligatoire pour tout don du sang, de sperme, de tissu ou d’organe.
- Tests de dépistage
1.1Tests immuno-enzymatiques
Il existe de très nombreux tests disponibles pour la détection des Ac anti VIH.
Les tests immuno-enzymatiques de type ELISA sont les plus largement utilisés. Ils permettent la détection des anticorps dirigés contre le VIH1 du groupe M et du groupe O ainsi que les différents sous types du VIH2 (tests mixtes). Ces tests reposent essentiellement sur deux principes : « indirect » et « sandwich ».Ils sont également classés en générations suite aux améliorations antigéniques apportées depuis la commercialisation des premiers tests en 1985.
Les tests de troisième génération appelés également « test Elisa sandwich » sont des tests plus sensibles et plus spécifiques que les tests de 2ème génération.
Des tests combinés permettant la détection simultanée des anticorps anti VIH et de l’antigène p24 sont également utilisés (4ème génération).
Les tests de 3ème et 4ème génération raccourcissent considérablement la période pré-sérologique.
1.2Tests simples / rapides
A côté des tests ELISA, des tests de réalisation simple sont disponibles.
Ces tests dits « rapides » font appel à une agglutination ou à une adsorption du complexe antigène-anticorps sur une membrane, suivie d’une coloration à l’œil nu.
- a. Tests d’agglutination
Ce sont des tests basés sur l’agglutination passive de particules sensibilisées VIH1 et VIH2 (mixtes).Ces tests semi- rapides réalisables entre 30 minutes à 2 heures, en général assez économiques, offrent une bonne résistance aux grands écarts de température ambiante.
Ils présentent une sensibilité comparable à celles des tests ELISA de deuxième et de troisième génération, mais ils manquent de spécificité et la lecture est subjective.
b.Tests rapides
Ce sont le plus souvent des tests dits par immunochromatographie, avec une filtration ou une migration du sérum sur une membrane ou un support recouverts d’antigènes VIH 1 et VIH 2 recombinants et/ou peptidiques.
Leur simplicité d’emploi leur assure une large diffusion. Ils ne nécessitent aucun équipement, Ils sont rapides car le résultat est donné en moins de 30 minutes. Par contre ils ne sont pas adaptés aux grandes séries.
Ces tests ont été améliorés et sont actuellement doués d’une bonne sensibilité et spécificité, seulement ne détectant pas l’Ag P24 ils manquent de sensibilité pour la primo infection.
- Test de confirmation
Le western blot est la méthode de référence .Il est pratiqué obligatoirement sur un second prélèvement (différent de celui utilisé pour le dépistage), de nombreux artefacts peuvent provenir du prélèvement ayant servi au dépistage (erreur d’enregistrement, erreur d’étiquetage contamination….).
Ce test met en évidence et, distingue les anticorps dirigés contre les différentes protéines du VIH1 ou du VIH 2 par une réaction immuno-enzymatique sous forme de bandes colorées.
Les critères d’interprétation sont proposés par divers organismes internationaux.
Selon l’OMS, un sérum est positif lorsqu’il a au moins deux Ac dirigés contre deux glycoprotéines d’enveloppe (gp160, gp120, gp41), associés à au moins un Ac dirigé contre une protéine interne du virus (p55, p40, p24..) ou protéines enzymatiques ( p66, p51, p31).Un résultat est négatif lorsqu’aucune bande n’est visualisée ou en la présence d’Ac anti p18 isolé.
Tableau n°2 : Critères d’interprétation du Western blot selon l’OMS :
| Interprétation | Profil |
| Positif | 2 ENV +/- GAG +/- POL |
| Indéterminé | 1 ENV +/- GAG +/- POL |
| GAG + POL | |
| POL | |
| GAG | |
| négatif | aucune bande |
| bandes non répertoriées |
L’inconvénient majeur du western blot est la difficulté d’interprétation dans le cas de profil indéterminé. Les causes possibles présentant ce type de profil sont retrouvées dans trois situations :
Une séroconversion
Une infection par le VIH2
Une réactivité non spécifique (en présence de facteurs rhumatoïdes, parasitoses, hypergammaglobulinémie…)
3.Algorithme de diagnostic
Le diagnostic biologique des infections par le VIH est basé sur la combinaison de plusieurs tests entre eux, au moins deux tests de dépistage (recommandations de l’OMS).
Cette combinaison aboutit à établir un algorithme de diagnostic qui doit prendre en considération plusieurs critères afin d’obtenir la meilleure valeur prédictive au moindre coût.
4. Diagnostic chez le nouveau né et le nourrisson de moins de 18mois
Les enfants nés de mères VIH 1positives sont bien évidemment séropositifs à la naissance ce qui ne veut pas dire qu’ils sont infectés. Les Ac maternels transmis ne disparaissent qu’après 15 à 18 mois après la naissance ce qui rend le diagnostic sérologique très difficile pendant cette période. Le diagnostic direct est, dans ce cas, l’approche la plus pertinente.
L’amplification génique (PCR) : elle peut être effectuée à partir des lymphocytes (qui contiennent l’ADN proviral) ou du plasma (qui contient l’ARN viral). la PCR permet de déceler dans la majorité des cas, l’infection dans le premier trimestre de la vie et souvent dés la naissance.
On peut également rechercher l’Ag viral par ELISA.
La confirmation de L’infection par le VIH est assurée par la détection des Ac anti VIH après l’âge de 18 mois.
Diagnostic d’une primo-infection
L’ARN viral plasmatique est le marqueur le plus précoce, il apparait entre les 10ème-12ème jours après le contage. Il est recherché par des techniques de biologie moléculaire (PCR)
, une recherche de l’Ag P24 est également possible à partir du 12ème jour après la contamination..Elle se fait par des tests ELISA.
Prévention de l’infection VIH
- Sexuelle : fidélité du couple, port du préservatif
- sanguine: transfusion sanguine : contrôle du sang, de ses dérivés et des organes (greffe)
- milieu de soins : respect des recommandations internationales
- Port de gants, port de lunettes protectrices
- interdiction de pippeter
- utilisation de containers adéquats et étanches pour les déchets solides (aiguilles, bistouris ) et pour le sang
- stérilisation du matériel réutilisable (hémodialyse, chirurgien dentiste, matériel d’investigation…etc.)
- mère-enfant
- dépistage chez la femme avant la grossesse
- dépistage chez la femme enceinte
- traitement antirétroviral préventif de la mère selon un protocole bien déterminé
- traitement antiretroviral préventif du nouveau né selon un protocole bien déterminé
- interdiction d’allaiter